Правая дуга аорты: что это, причины, варианты развития, диагностика, лечение, когда опасна?
Правая дуга аорты у плода является врожденным пороком сердца, который может возникать изолированно или сочетаться с другими, порой тяжелыми, пороками. В любом, случае, при формировании правой дуги возникают нарушения нормального развития сердца плода.
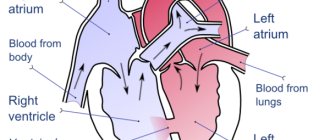
Аорта является крупнейшим сосудом в организме человека, функцией которого является продвижение крови от сердца к другим артериальным стволам, вплоть до артерий и капилляров всего организма.
Филогенетически развитие аорты претерпевает сложные изменения в процессе эволюции. Так, формирование аорты как целостного сосуда, происходит только у позвоночных животных, в частности, у рыб (двухкамерное сердце), амфибий (двухкамерное сердце с неполной перегородкой), рептилий (трехкамерное сердце), птиц и млекопитающих (четырехкамерное сердце). Тем не менее, у всех позвоночных имеется аорта, в которую происходит отток артериальной крови, смешанной с венозной, или полностью артериальной крови.
В процессе индивидуального развития эмбриона (онтогенеза) формирование аорты претерпевает столь же сложные изменения, как и само сердце. Начиная с первых двух недель развития эмбриона, происходит усиленное сближение артериального ствола и венозного синуса, расположенных в шейной части эмбриона, впоследствии мигрировавших медиальнее, в сторону будущей грудной полости. Артериальный ствол дает начало не только двум желудочкам впоследствии, но и шести жаберным (артериальным) дугам (по шесть с каждой стороны), которые по мере развития, в течение 3-4-х недель, формируются следующим образом:
- первая и вторая аортальные дуги редуцированы,
- третья дуга дает начало внутренним сонным артериям, питающим головной мозг,
- четвертая дуга дает начало дуге аорты и так называемой «правой» части,
- пятая дуга редуцируется,
- шестая дуга дает начало легочному стволу и артериальному (Боталлову) протоку.
Полностью четырехкамерным, с четким разделением сердечных сосудов на аорту и легочной ствол, сердце становится к шестой неделе развития. У эмбриона сроком 6 недель имеется полностью сформированное, сокращающееся сердце с крупными сосудами.
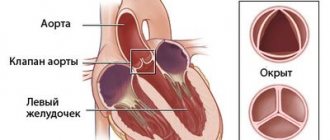
После формирования аорты и других внутренних органов, топография сосуда выглядит следующим образом. В норме левая дуга аорты начинается от луковицы аорты в ее восходящей части, которая, в свою очередь, берет начало от левого желудочка. То есть, восходящая часть аорты переходит в дугу приблизительно на уровне второго ребра слева, а дуга огибает левый главный бронх, направляясь кзади и влево. Самая верхняя часть дуги аорты проецируется на яремную вырезку прямо над верхней частью грудины. Дуга аорты направляется книзу вплоть до четвёртого ребра, располагаясь левее позвоночника, а затем переходит в нисходящую часть аорты.
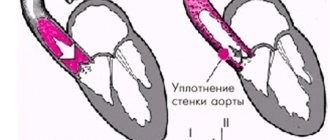
В том случае, когда дуга аорты «поворачивает» не в левую сторону, а в правую, из-за сбоя в закладке сосудов человека из жаберных дуг эмбриона, говорят о правосторонней дуге аорты. При этом дуга аорты перекидывается через правый главный бронх, а не через левый, как должно быть в норме.
Любой порок развития формируется у плода в том случае, если на женщину во время беременности оказывают влияние негативные факторы окружающей среды — табакокурение, алкоголизм, наркомания, экология и неблагоприятный радиационный фон. Однако, немаловажную роль в развитии сердца у ребенка играют генетические (наследственные) факторы, а также имеющиеся хронические заболевания у матери или перенесенный инфекционные заболевания, особенно на ранних сроках беременности (грипп, герпетическая инфекция, ветрянка, краснуха, корь, токсоплазмоз и многие другие).
Но, в любом случае, при влиянии каких-либо из этих факторов на женщину на ранних сроках беременности нарушаются нормальные, сформированные в ходе эволюции, процессы онтогенеза (индивидуального развития) сердца и аорты.
Так, в частности, особенно уязвимым для сердца плода является срок беременности приблизительно 2-6 недель, так как именно в это время происходит формирование аорты.
Что такое брюшная аорта и где она расположена?
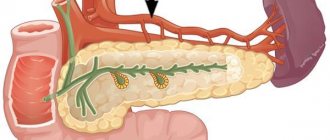
Как известно, самая крупная артерия человека – аорта – состоит из нескольких отделов. Большинство из них расположены в пределах грудной клетки. Лишь одна часть (брюшная или абдоминальная) проходит в полости живота, под диафрагмой. На всем протяжении она находится спереди от позвоночника и питает артериальной кровью всю нижнюю половину тела.
Анатомия брюшной аорты
Топографически этот сосуд начинается на уровне 12-го грудного позвонка, выходя из аортального отверстия диафрагмы. В брюшной полости аорта смещается кпереди от позвоночного столба, немного левее от срединной линии. На всем протяжении сосуд отдает множественные ветви, питающие структуры полости живота.
Размеры брюшной аорты в норме:
- длина – от 13 до 15 см;
- диаметр – 18-20 мм.
Заканчивается абдоминальная аорта на уровне 4-го или 5-го поясничного позвонка, в точке бифуркации (т. е. раздвоения), где она расходится на правую и левую подвздошные артерии.
Сзади от абдоминальной аорты расположен позвоночник, спереди – корень брыжейки тонкого кишечника, поджелудочная железа и двенадцатиперстная кишка. Справа проходит нижняя полая вена, а слева – левый надпочечник и почка.
Ветви брюшного отдела делятся на париетальные (питающие стенку живота) и висцеральные (снабжают внутренние органы).
К первой группе относятся такие парные артерии:
- нижняя диафрагмальная;
- поясничные (по 4 с каждой стороны);
- непарная крестцовая.
Висцеральные ветки бывают парные и непарные.
К парным относятся:
- средняя супраренальная;
- ренальная (почечная);
- тестикулярная (у женщин – овариальная), которые кровоснабжают половые органы.
- чревный ствол, который отдает ветки к печени, желудку, селезенке;
- верхняя и нижняя брыжеечные, питающие все отделы кишечника.
На фото вы можете увидеть схему расположения отходящих веток
:
Классификация правосторонней дуги аорты
вариант правой дуги аорты с образованием сосудистого кольца
В зависимости от анатомии аномалии протока, выделяют:
- Правую дугу аорты без образования сосудистого кольца, когда артериальная связка (заросший артериальный, или Боталлов, проток, как и должно быть в норме после родов) располагается позади пищевода и трахеи,
- Правую дугу аорты с образованием сосудистого кольца, кода артериальная связка, или открытый артериальный проток, располагаются слева трахеи и пищевода, как бы окружая их.
- Также как отдельную сходную форму выделяют двойную дугу аорты — в таком случае сосудистое кольцо образуется не соединительной связкой, а притоком сосуда.
Рисунок: разнообразие вариантов нетипичного строения дуги аорты
В зависимости от того, были ли повреждены еще какие-либо структуры сердца при его формировании, выделяют следующие типы порока:
- Изолированный тип порока, без других аномалий развития (в таком случае если правосторонняя аорта не сочетается с характерным в ряде случаев для неё синдромом Ди Джорджи — прогноз максимально благоприятен);
- В сочетании с декстрапозицией (зеркальным, правым расположением сердца и магистральных сосудов, в том числе и аорты), (что также обычно не опасно),
- В сочетании с более серьезным пороком сердца — в частности тетрадой Фалло (декстрапозицией аорты, дефектом межжелудочковой перегородки, стенозом легочного ствола, гипертрофией правого желудочка).
Тетрада Фалло, сочетающаяся с правой дугой — неблагоприятный вариант развития
Диагностика порока не представляет собой затруднений еще в период вынашивания плода. Особенно это касается тех случаев, когда правая дуга аорты сочетается с другими, более тяжелыми аномалиями развития сердца. Тем не менее, для подтверждения диагноза, беременную женщину неоднократно обследуют, в том числе и на ультразвуковых аппаратах экспертного класса, собирают консилиум из врачей генетиков, кардиологов и кардиохирургов с принятием решения о прогнозах и возможности родоразрешения в условиях специализированного перинатального центра. Это обусловлено тем, что при некоторых видах пороков, сочетающихся с правой дугой аорты, новорожденному ребенку может потребоваться операция на сердце сразу же после родоразрешения.
Относительно клинических проявлений правой дуги аорты, следует упомянуть о том, что изолированный порок может никак себя не проявлять, лишь иногда сопровождаясь частой навязчивой икотой у ребенка. В случае сочетания с тетрадой Фалло, которая сопровождает порок в ряде случаев, клинические проявления ярко выражены и проявляются в первые сутки после родов, такие, как нарастающая легочно-сердечная недостаточность с выраженным цианозом (посинение кожи) у младенца. Именно поэтому тетраду Фалло относят к «синим» порокам сердца.
На каком скрининге видно порок у беременных?
Дополнительно уточнить отсутствие связи формирования правосторонней аорты с тяжелыми генетическими мутациями может анализ ДНК плода. В таком случае обычно проводится забор материала ворсин хориона или амниотической жидкости через прокол. В первую очередь исключается синдром Ди Джорджи.
В том случае, если правая дуга аорты является изолированной, и не сопровождается какими-либо клиническими проявлениями после рождения ребенка, порок оперативного лечения не требует. Достаточно лишь ежемесячного осмотра у детского кардиолога с регулярным (раз в полгода — раз в год) проведением УЗИ сердца.
При сочетании с другими пороками развития сердца тип оперативного вмешательства выбирается исходя из типа пороков. Так, при тетраде Фалло показана операция на первом году жизни ребенка, проводящаяся поэтапно. На первом этапе осуществляют паллиативное (вспомогательное) наложение шунтов между аортой и легочным стволом для улучшения притока крови в малый круг кровообращения. На втором этапе осуществляется операция на открытом сердце с применением аппарата искусственного кровообращения (АИК) с целью устранения стеноза легочного ствола.
Кроме хирургического, со вспомогательной целью назначаются кардиотропные препараты, способные замедлить прогрессирование хронической сердечной недостаточности (ингибиторы АПФ, мочегонные и др).
Прогноз при изолированной правосторонней дуге аорты благоприятен, так как в большинстве случаев даже не требуется хирургического вмешательства. Так что в целом можно сказать, что изолированная правая дуга аорты не опасна для жизни ребенка.
При сочетанных типах дело обстоит гораздо сложнее, так как прогноз определяется видом сопутствующего порока сердца. Например, при тетраде Фалло прогноз без лечения крайне неблагоприятен , непрооперированные дети с таким заболеванием обычно погибают на первом году жизни. После хирургического вмешательства продолжительность и качество жизни возрастают, а прогноз становится более благоприятным.
Источник: sosudinfo.ru
Причины развития
Как уже говорилось, гипоплазия является так называемой гипотрофией сосудов аорты, и она несет за собой деформацию пластичной оболочки. Все это со временем приводит к прерыванию перешейка аорты. Причинами этого могут служить разного рода гормональные сбои, патологии, генетика, сбои в иннервации. Также данная болезнь может привести к сбоям в работе почечной артерии.
К коарктации могут привести похожие причины:
- передача болезни наследственно; Негативное влияние экологии; генетическая предрасположенность в сочетании с иными факторами; вирусные заболевания на первых 8 неделях беременности; прием медикаментов на ранних стадиях беременности; наркотики и курение; стрессы и нервные срывы; постоянное злоупотребление алкоголем; регулярное употребление кофе; работа с едкими веществами; разные заболевания будущей матери; беременность в возрасте старше 35 лет.
Таким образом, стоит сказать, что гипоплазию стоит отнести к редко патологии с не атеросклеротическим и не воспалительным характером сужения аорты. Здесь в основном для лечения применяется только хирургический метод, что снижает риск смерти или возникновения осложнений. Также при лечении данных заболеваний обязательно должно проводиться реконструкция мезентеральных и почечных артерий.
Правая дуга аорты у плода последствия для ребенка в будущем
Как часто встречаются, и могут ли они «пройти» без операции?
Врожденные пороки сердца (ВПС) являются одной из самых распространенных аномалий развития и, согласно статистике, встречаются с частотой 7-15 случаев на 1000 новорожденных. В Красноярском крае в структуре врожденных пороков развития пороки сердечно-сосудистой системы новорожденных стоят на первом месте и составляют 42,6% от всех пороков.
Они являются основной причиной младенческой летальности. Среди детей, рождающихся с ВПС, 14-29% умирают в первую неделю жизни, 19-42% — в течение первого месяца, 30% младенцев не доживают до одного года. ВПС становятся причиной до 50% всех летальностей от всех пороков развития.
Врожденные пороки развития сердечно-сосудистой системы могут быть представлены в изолированной форме или являться составной частью комплекса множественных врожденных пороков развития. Могут сочетаться с наследственными заболеваниями. Описано, более чем при 40 хромосомных аномалиях, сопровождающие ВПС.
Тератогенные факторы, вызывающие врожденные пороки развития, в том числе сердечно-сосудистой системы принято подразделять на три группы: генетические; экзогенные; сочетанные экзогенные и генетические (мультифакториальный генез).
К генетическим тератогенным факторам относятся хромосомные аберрации (числовые, структурные), мутации генов, вызывающие пороки развития с доминантным или рецессивным типом наследования.
К экзогенным факторам относятся вирусные инфекции, фармакологические препараты, алкогольные напитки, курение табачных изделий, промышленные ядовитые вещества и так далее.
К мультифакториальным факторам относят случаи сочетанного эффекта при воздействии экзогенного фактора на предрасположенный к дефекту организм. Основная масса врожденных заболеваний, в том числе и пороки сердца, имеет мультифакториальный генез (50-78%). Для формирования пороков развития имеют значения сроки воздействия тератогенных факторов на развивающиеся органы и системы плода. Например, эмбриональный период со 2 по 8 неделю беременности принято считать критическим периодом развития, он является наиболее уязвимым для неблагоприятных воздействий на развивающееся сердце и другие формирующиеся органы плода. Так как развивающийся эмбрион и плод очень чувствительны к неблагоприятным факторам, то они могут вызвать гибель эмбриона (плода), пороки развития от тяжелых, несовместимых с жизнью, до легких аномалий развития, а также функциональные нарушения, которые могут проявиться сразу же после рождения или в дальнейшем.
В настоящее время профилактикой наследственных болезней и врожденных пороков развития занимается КГБУЗ «Красноярский краевой медико – генетический центр». Работа медико – генетического центра организована на основании постановлений Правительства РФ и постановлений Правительства Красноярского края, приказов МЗ РФ, приказов МЗ Красноярского края. Проводится и постоянно совершенствуется работа по следующим направлениям: медико–генетическое консультирование, пренатальная диагностика нарушений развития ребенка, скрининг новорожденных на 5 наследственных болезней, диспансеризация семей с наследственной патологией, мониторинг врожденных пороков развития.
Ежегодно проводимый мониторинг исходов врожденных пороков развития сердечно-сосудистой системы у новорожденных и плодов позволяет оценить количество и структуру врожденных пороков развития сердца в пренатальный период, то есть в период ещё внутриутробного развития плода, и в неонатальный период, а также проследить, какой объём специализированной помощи был оказан, какие были осложнения и сопутствующая патология.
Открытие в г. Красноярске ФГБУ «Федеральный Центр сердечно-сосудистой хирургии» позволяет не только проводить комплексное обследование детей с врожденными пороками сердца, по показаниям назначать терапевтическое лечение и диспансеризацию, но и проводить хирургическое лечение уже с раннего неонатального периода. Сегодня современные возможности оперативных вмешательств достаточно велики. Как показывает опыт, не всем детям необходимо вмешательство сразу при выявлении патологии со стороны сердца и главных артерий. Одни дети не подлежат операции из-за незначительности анатомических нарушений, другие, наоборот, невозможности коррекции порока и тяжелой внесердечной патологии. Для планирования помощи при ВПС важно оценить гемодинамическую значимость заболеваний и вероятность развития критических состояний при них. На положительный исход влияет раннее выявление врожденной патологии сердца у детей.
ВПС – это группа состоит из очень многих нозологических форм, и она имеет тенденцию к расширению за счет совершенствования и внедрения в медицинскую практику диагностических методов исследования.
Среди ВПС дефекты интракардиальных перегородок относятся к одним из наиболее частых врожденных пороков сердца, могут встречаться с частотой до 60% от всех ВПС у плодов и у новорожденных. Они могут быть гемодинамически значимыми и преимущественно в 90% гемодинамически незначимыми. Бывают дефекты межпредсердной (ДМПП), межжелудочковой (ДМЖП) и аортопульмональной перегородок. Могут быть единичными или множественными. Крайней степенью проявления множественных мышечных дефектов является перегородка в виде «швейцарского сыра».
В структуре дефектов интракардиальных перегородок чаще встречаются дефекты межжелудочковой перегородки. При изолированном дефекте межжелудочковой перегородки остальные отделы сердца развиты нормально. Во внутриутробном периоде маленький (менее 4 мм) ДМЖП не оказывает влияния на гемодинамику и развитие плода. Среди выявленных дефектов маленькие гемодинамически незначимые чаще закрываются к моменту рождения и таким образом не оказывают влияния на прогноз для жизни и здоровья новорожденного.
Частота маленьких, гемодинамически незначимых ДМЖП новорожденных составляет свыше 50 случаев на 1000 новорождённых, большинство этих дефектов спонтанно закрывается к 1-2 годам жизни. Процесс закрытия дефекта может продолжаться до 10 лет. К сожалению, невозможно предсказать течение дефекта в каждом конкретном случае.
В настоящее время увеличение частоты выявления дефектов интракардиальных перегородок среди плодов и «здоровых новорождённых» связано с проведением эхокардиографии с использованием цветного допплеровского сканирования, которое позволяет обнаруживать мелкие дефекты.
ДМЖП составляют до 20-30% всех изолированных ВПС. Они описаны более чем при 40 хромосомных аномалиях и при 90 синдромах множественных пороков развития.
Клинически значимые дефекты межпредсердной перегородки (ДМПП) встречаются с частотой 0,24-0,58 на 1000 новорождённых, дефекты межжелудочковой перегородки (ДМЖП)- с частотой 0,38-2,26 на 1000 новорождённых. Частота критических состояний в этой группе больных может быть около 21%. У больных с ДМЖП обычно имеются сопутствующие аномалии сердца: ДМПП, открытый артериальный проток, коарктация аорты, стеноз легочного или аортального клапана, аортальная недостаточность. Показаниями к хирургическому вмешательству служат сердечная недостаточность и задержка физического развития у детей, не поддающихся терапии.
Такие пороки развития сердечно-сосудистой системы, как транспозиция магистральных сосудов, тетрада Фалло, атрезия легочной артерии, стеноз легочной артерии, гипопластический синдром левых отделов сердца, коарктация аорты, прерывание дуги аорты, двойной выход главных артерий из правого желудочка, общий артериальный ствол, открытый артериальный проток встречаются с частотой свыше 30% от всех ВПС. Эти пороки развития являются гемодинамически значимыми, и вероятность развития критических состояний у детей в первые дни, недели, месяцы, в течение первого года жизни высока: от 30 до 100%. Понятно, что возможность оказания хирургической помощи при подобных патологиях определяется их выявляемостью в первые недели, месяцы жизни.
Дородовому выявлению врожденных пороков сердца способствует развитие пренатальной диагностики. В основе раннего выявления любого врожденного порока развития плода лежит хорошо организованная система скринингового обследования, в том числе ультразвукового, беременных женщин. Ультразвуковое исследование является основным прямым неинвазивным методом для выявления ВПС и применение его в комплексе с другими методами исследования повышает эффективность пренатальной диагностики. Эхография отличается от других методов исследования сочетанием таких качеств, как неинвазивностью, высокой информативностью, безопасностью, возможностью многократного применения у одной пациентки.
В скрининговые сроки пренатального периода (11 недель, 3 дня — 13 недель, 6 дней; 19 — 21 недель; 30 — 34 недели) проводится комплексное эхокардиографическое исследование плода. Эти сроки беременности являются оптимальными для выявления врожденных пороков развития плода. Использование расширенной схемы исследования позволяет правильно идентифицировать изменения сердца и главных артерий, провести полноценную дифференциальную диагностику и установить окончательный пренатальный диагноз многих ВПС. При обнаружении ВПС учитывается риск хромосомных аномалий, риск сочетанных аномалий, риск нехромосомных синдромов. Пренатальная тактика в случае выявления ВПС заключается в том, что семья беременной женщины на пренатальном консилиуме, который регулярно проводится на базе КГБУЗ «Красноярский краевой медико-генетический центр» от специалистов получает полную информацию о характере поражения плода, возможных исходах беременности, прогнозе для жизни, качества и здоровья будущего ребенка, возможных вариантах лечения и принимает осознанное решение.
Источник: angarochka.ru
Восходящая часть аорты
pars
ascendensaortae,
выходит из левого желудочка позади левого края грудины на уровне третьего межреберья; в начальном отделе она имеет расширение — луковицу аорты,
bulbusaortae.
В месте расположения клапана аорты на внутренней стороне аорты имеется три синуса,
sinusaortae.
От начала восходящей, части аорты отходят правая и левая венечные артерии.